Regulationsmechanismen der dehnungssensitiven Zwei-Porendomänen Kaliumkanäle K2P2.1 (TREK-1) und K2P10.1 (TREK-2)
Seiten
2021
VVB Laufersweiler Verlag
978-3-8359-6938-4 (ISBN)
VVB Laufersweiler Verlag
978-3-8359-6938-4 (ISBN)
- Keine Verlagsinformationen verfügbar
- Artikel merken
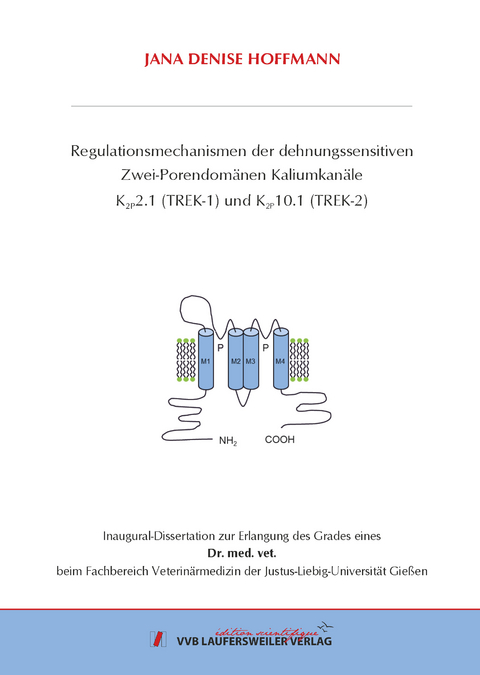
Die in der vorliegenden Promotionsarbeit charakterisierten und analysierten Ionen-kanäle K2P2.1 und K2P10.1 gehören zur Familie der Zwei-Porendomänen Kaliumkanäle. Neben ihrer neuronalen Expression sind diese u.a. an der myokardialen Erregungsleitung sowie an der Repolarisationsphase erregbarer Zellen beteiligt und tragen zur Stabilisierung des Ruhemembranpotentials bei. K2P-Kanäle unterliegen einer komplexen Regulation, die von chemischen oder mechanischen Stimuli über eingehend bekannte intrazelluläre Signaltransduktionswege bis zur modulierenden Aktivität spezifischer Proteinbindungspartner reicht. Mit Hilfe der genannten Regulationsmechanismen werden nicht nur die jeweiligen Stromamplituden beeinflusst, sondern auch die quantitative und qualitative Expression der Kanalproteine. Auf diese Weise stellt die Regulation von K2P-Kanälen einen Kontrollmechanismus dar, der einen wesentlichen Einfluss auf die Erregbarkeit von Neuronen und Kardiomyozyten hat. In der vorliegenden Arbeit konnten neue Regulationsmechanismen für human- und rattenspezifische K2P2.1 und K2P10.1 Kaliumkanäle elektrophysiologisch und biochemisch nachgewiesen werden, die primär in Oozyten des Krallenfrosches Xenopus laevis, eingeschränkt auch in humanen HEK293 Zellen, durch mRNA Injektion zur membranständigen Expression ge-bracht wurden.
In einer ersten Teilstudie an rattenspezifischen rK2P2.1 Kanälen konnten die bis dato nur mit spannungsabhängigen Kaliumkanälen in Verbindung gebrachten β Untereinheiten rKvß1 - rKvß4 als funktionelle Interaktionspartner auch von rK2P2.1 identifiziert werden. So hatte vor allem die erfolgreiche konzentrations- und zeitabhängige Coexpression der rKvß2 mRNA eine signifikante Zunahme des mittels voltage-clamp Technik erfassten, rK2P2.1 spezifischen Ionenstroms zur Folge. Zusätzlich errechnete sich eine zwar geringfügige aber signifikante Reduktion der halbmaximalen Aktivierungsspannung des rK2P2.1 Kanals durch Interaktion mit der rKvß2 Untereinheit sowie eine Hyperpolarisation der Zellmembran. Die Coexpression der rKvβ2 Untereinheit mit durch Punktmutation bzw. Deletion des N-Terminus erzeugten alternativen Translationsinitiationsvarianten (ATI-Varianten) des rK2P2.1 Kaliumkanals ergab keine eindeutigen Hinweise auf die Beteiligung seiner N-terminalen Aminosäuresequenz an der Protein-Protein Interaktion. Eine direkte Interaktion beider Proteine konnte darüber hinaus auch nicht durch Coimmunpräzipitation, SDS Gelektrophorese und Detektion beider Proteine durch den Einsatz tag spezifischer Antikörper im Western Blot nachgewiesen werden, was zumindest teilweise auf eine sterische Behinderung der Immunglobuline zurückgeführt werden könnte. Zudem konnte die membranständige Expression des rK2P2.1 Proteins durch Coexpression der rKvß2 Untereinheit nicht erhöht werden. Möglicherweise stellt das funktionelle Zusammenspiel von rK2P2.1 Kanalprotein mit einer akzessorischen rKvβ Untereinheit und die damit verbundene Hyperpolarisation der Zelle ein neuartiges Konzept in der antiepileptischen, neuroprotektiven und/oder antiarrhythmischen Therapie dar. In weiterführenden Studien wird es also weiterhin von Bedeutung sein, den zugrunde liegenden Mechanismus der Kanalaktivierung zu identifizieren.
In einer weiteren Teilstudie der vorliegenden Arbeit konnte nachgewiesen werden, dass alternatives Spleißen als übergeordneter Regulationsmechanismus die alternative Translationsinitiation des humanen hK2P10.1 Kaliumkanals kontrolliert. Dabei konnte gezeigt werden, dass beim alternativen Spleißen durch Rekombination des ersten Exons drei unterschiedliche hK2P10.1 Isoformen (IF) ausgebildet und gewebsspezifisch exprimiert werden (Gehirn: IF1 und IF2; Herz: IF2). Zusätzlich wurde durch alternatives Spleißen die Translationsinitiationssequenz (TIS) vor dem ersten Startcodon verändert. Die biochemischen Western Blot Analysen konnten zweifelsfrei nachweisen, dass die TIS vor dem ersten Startcodon die Translation an den Ribosomen unterschiedlich stark initiiert; dabei handelt es sich nicht um eine posttranslationale Proteinmodifikation. Eine geringe Affinität der TIS für das erste Startcodon kann zum sogenannten “leaky scanning“ führen, wobei der Translationsbeginn an einem weiter “downstream“ positionierten Startcodon stattfindet. Dadurch kam es auch in der vorliegenden Arbeit zur Translation von Kanalproteinen mit unterschiedlicher Länge des N-Terminus. Für jede der drei IFs konnten drei Startcodons im offenen Leseraster identifiziert und mittels Western Blot Analyse biochemisch dargestellt werden. Die mit Hilfe von Xenopus laevis Oozyten gewonnenen Ergebnisse konnten anschließend in HEK293 Zellen bestätigt werden.
Elektrophysiologisch wurden in mit mRNA injizierten Xenopus laevis Oozyten mittels voltage-clamp Technik Stromableitungen und Ruhemembranpotentiale sowohl von Wildtypen aller IFs als auch von homomer aufgebauten ATI-Varianten der ein-zelnen hK2P10.1 IFs aufgezeichnet. Dabei zeigte sich bei den Wildtypen, dass IF2 im Vergleich die größten Stromamplituden aufwies und die Oozyte am wenigstens depolarisiert wurde. Die Gegenüberstellung der Stromamplituden aller ATI-Varian-ten spiegelte zum einen wider, dass diejenigen der Wildtypen aus dem Zusammenspiel aller drei möglichen Kanalproteine bestanden und zum anderen, welches Kanalprotein die Stromamplitude maßgeblich bestimmte. Dabei wiesen die Kanalproteine mit dem kürzesten N-Terminus übereinstimmend bei allen drei IFs deutlich geringere Kaliumströme auf und die entsprechenden Oozyten depolarisierten am stärksten. Die elektrophysiologischen Ergebnisse bestätigten die biochemischen Analysen. Spleißen der mRNA und die alternative Translationsinitiation bestimmen die gewebsspezifische Proteinvariabilität und beeinflussen somit die Feinregulation des Ruhemembranpotentials. IF-abhängige Proteineigenschaften sorgen für eine unterschiedlich ausgeprägte Depolarisation der Zelle. Hierdurch könnte die Entstehung von Arrhythmien begünstigt und daher die gezielte Beeinflussung der Proteinexpression als Ansatz für neue Therapiekonzepte genutzt werden.
In einer dritten Teilstudie sollte der Effekt des nicht-selektiven β-Adrenozeptor Antagonisten Carvedilol auf hK2P2.1 und hK2P10.1 Kanäle sowie deren ATI-Varianten analysiert werden. Neben dem Einsatz als Antihypertonikum wirkt sich die Gabe von Carvedilol bei der Behandlung von Herzinsuffizienz nachweislich prognostisch günstig aus. Darüber hinaus senkt es das Auftreten von Arrhythmien nach Myokardinfarkten und minimiert die Rezidivrate von Vorhofflimmern nach erfolgter Kardioversion.
In mit spezifischer mRNA transfizierten Xenopus laevis Oozyten ließ sich sowohl für den hK2P2.1 als auch den hK2P10.1 Kaliumkanal eine konzentrationsabhängige Inhibition der durch Spannungsimpulse induzierten Stromamplitude durch Carvedilol nachweisen. Der hK2P2.1 Kanal wurde dabei sowohl in geöffnetem als auch geschlossenem Zustand inhibiert und die Inhibition unterlag keiner Frequenzabhängigkeit. Im Vergleich zum Wildtyp zeigten die ATI-Varianten beider Kanäle eine differentielle Sensitivität für Carvedilol. Dabei war übereinstimmend zu registrieren, dass mit Verkürzung des N-Terminus die pharmakologische Sensitivität abnahm. Die dargestellten Ergebnisse liefern Hinweise dafür, dass die antiarrhythmische Wirkung von Carvedilol zumindest teilweise auf die Inhibition kardialer K2P-Kanäle zurückzuführen ist. Außerdem konnte nachgewiesen werden, dass ATI neben der Beeinflussung der Proteinvariabilität und elektrophysiologischer Eigenschaften durch Verkürzung des N-Terminus die Kanalpharmakologie von Carvedilol beeinflusst. Infolge spatiotemporal unterschiedlicher Expressionsmuster der ATI-Varian-ten wäre somit mit unterschiedlichen pharmakologischen Effekten durch den Einsatz von Carvedilol zu rechnen.
Die präsentierten Ergebnisse unterstreichen die Bedeutsamkeit der K2P-Kanäle für die Regulation zellulärer Erregbarkeit. Als feine Stellschrauben können sie die Zelle sowohl hyper- als auch depolarisieren. Im Gesamtkontext der Zellphysiologie oder durch Dysregulation kann somit die Entstehung von Arrhythmien begünstigt oder verhindert werden. Gleichzeitig bietet dieses Verständnis Ansätze für neuartige Therapiekonzepte. Die vorgestellten Regulationsmechanismen stellen die Basis für das Verständnis funktioneller Eigenschaften von K2P2.1 und K2P10.1 Kanälen dar, bedürfen aber weiterführender Studien, um Zusammenhänge zu Physiologie und Pathophysiologie der K2P-Kanäle herzustellen. The ion channels K2P2.1 and K2P10.1 represent members of the two-pore-domain potassium (K2P) channel family. Beside their predominant expression in neuronal tissue, they were also detected in cardiac myocytes. K2P channels stabilize the resting membrane potential and facilitate action potential repolarization. Polymodal regulation by chemical and physical stimuli, G-protein coupled receptor pathways and specific protein binding partners modulates the channel properties and results in quantitative and qualitative expression pattern. The regulation of K2P currents represents a control mechanism to determine cellular excitability. This study presents novel mechanisms of both human and rat specific K2P2.1 and K2P10.1 potassium channel regulation, employing electrophysiological and biochemical approaches primarily in Xenopus laevis oocytes but also human HEK293 cells.
Auxiliary β subunits were previously assumed to selectively associate with voltage-gated potassium channels. In the present work, the rat specific ß subunits rKvβ1 - rKvβ4 were shown to interact functionally with rK2P2.1 potassium channels. In the presence of rKvβ2 protein, rK2P2.1 channel currents increased in a concentration- and time-dependent manner and significantly hyperpolarized the resting mem- brane potential. Also co-expression of rKvβ1, rKvβ3 and rKvβ4 similarly induced concentration-dependent rK2P2.1 current enhancement. In addition, a minor but significant reduction in half maximal activation voltage in the presence of rKvß2 expression could be calculated. Co-expression of rKvβ2 and rK2P2.1 ATI variants (rK2P2.1 M57I, rK2P2.1 Δ1-56) did not provide distinct evidence for the involvement of the N-terminus in functional interaction. Neither an increased surface protein expression nor a stable rK2P2.1 interaction with rKvß2, assessed by co-immuno-precipitation assays, could be identified as underlying molecular mechanism. The rKvβ2 mediated increase in rK2P2.1 currents and associate resting membrane potential hyperpolarization imply a potential novel antiepileptic, neuroprotective or antiarrhythmic concept. Reduced or absent expression of rK2P2.1 or the loss of rKvβ2 may account for the development of epilepsy and mental disorders in vivo.
In another partial study of the present work it could be demonstrated that alternative mRNA splicing as overall regulatory mechanism determines translation initiation and contributes to protein diversity and function of hK2P10.1. Through recombination of the first exon, alternative splicing of hK2P10.1 mRNA produces three different transcript variants (isoforms), which were expressed in a tissue-specific manner (brain: isoform 1 and 2; heart: isoform 2). Additionally alternative splicing regulates translation start site by recombination a short nucleotide sequence (translation initiation sequence, TIS, Kozak sequence) preceeding the first start codon. Western blot analysis of Xenopus laevis oocyte lysates confirmed differential translation initiation at the first start codon due to a strong or weak TIS; this doesn’t represent posttranslational protein modification. If the first start codon is surrounded by a weak nucleotide context it may be resulted in leaky scanning and translation starts at a downstream position. Alternative translation initiation (ATI) generates protein subunits, which differ in their N-terminal length. For each isoform, three start codons could be detected in the open reading frame revealed by Western blot analysis. Biochemical key observations from mRNA expression in Xenopus laevis oocytes were extended to cDNA expression in human embryonic kidney cells and resembled the previous findings.
Using the two-electrode voltage clamp technique, potassium currents and resting membrane potentials of hK2P10.1 isoform wild types and homomeric ATI variants were recorded to study electrophysiological properties. In comparison to the other channel wild type forms, hK2P10.1 isoform 2 yielded currents with the greatest magnitude and associated oocyte hyperpolarization. Expression of single subunits of ATI variants reflected the current composition in K2P10.1 isoform wild types. In all three isoforms ATI variants with most severely truncated N-terminus displayed distinct reduced outward currents and depolarizing resting membrane potentials. These electrophysiological results were confirmed by the biochemical observa-tions.
Messenger RNA splicing and alternative translation initiation determine tissue-specific protein variability and regulate cell excitability. Isoform-dependent effects on K2P10.1 currents were accompanied by changes in resting membrane potential, which could promote the development of arrhythmias or could be used as novel concept of therapy by selective protein expression.
Finally, the effect of the non-selective β-receptor antagonist carvedilol on hK2P2.1, hK2P10.1 and their ATI variants was examined. In addition to the clinical use in patients with hypertension, carvedilol improves the clinical outcome in heart failure patients. Carvedilol decreases the occurrence of arrhythmias after myocard infarction and minimizes the recurrence of atrial fibrillation after cardioversion. As previously reported for hK2P3.1, carvedilol also inhibited hK2P2.1 and hK2P10.1 potassium currents in Xenopus laevis oocytes in a concentration-dependent manner. In contrast to K2P3.1 the derived IC50 value did not reach clinical plasma concentrations. The inhibition of the hK2P2.1 channel was neither state- nor frequency-dependent. Compared with full-length K2P channels, truncated isoforms of hK2P2.1 and hK2P10.1 produced by ATI were differentially regulated by carvedilol. N terminal shortened ATI variants displayed reduced sensitivity to carvedilol.
The results provide evidence for the contribution of K2P channel inhibition to the antiarrhythmic effect of carvedilol. In addition to increasing protein diversity and controlling electrophysiological channel properties by truncated N-terminus, this work identifies ATI as a genetic mechanism regulating sensitivity of hK2P2.1 and hK2P10.1 channels to carvedilol. Differential expression of ATI-dependent K2P channel variants may result in spatiotemporal variation of electrophysiological carvedilol effects in the heart.
The findings from this work confirm the significance of K2P channels for the regulation of cellular excitability. Activation or inhibition results in cell hyper- or depolarization. In the context of cell physiology or in case of dysregulation, cardiac arrhythmias may be triggered or prevented. These findings provide novel approa-ches for the treatment of arrhythmias. The regulatory mechanisms identified here represent the basis for understanding functional properties of K2P2.1 and K2P10.1 potassium channels. Further investigation is needed to assess the role of K2P channel regulation in physiology and disease.
In einer ersten Teilstudie an rattenspezifischen rK2P2.1 Kanälen konnten die bis dato nur mit spannungsabhängigen Kaliumkanälen in Verbindung gebrachten β Untereinheiten rKvß1 - rKvß4 als funktionelle Interaktionspartner auch von rK2P2.1 identifiziert werden. So hatte vor allem die erfolgreiche konzentrations- und zeitabhängige Coexpression der rKvß2 mRNA eine signifikante Zunahme des mittels voltage-clamp Technik erfassten, rK2P2.1 spezifischen Ionenstroms zur Folge. Zusätzlich errechnete sich eine zwar geringfügige aber signifikante Reduktion der halbmaximalen Aktivierungsspannung des rK2P2.1 Kanals durch Interaktion mit der rKvß2 Untereinheit sowie eine Hyperpolarisation der Zellmembran. Die Coexpression der rKvβ2 Untereinheit mit durch Punktmutation bzw. Deletion des N-Terminus erzeugten alternativen Translationsinitiationsvarianten (ATI-Varianten) des rK2P2.1 Kaliumkanals ergab keine eindeutigen Hinweise auf die Beteiligung seiner N-terminalen Aminosäuresequenz an der Protein-Protein Interaktion. Eine direkte Interaktion beider Proteine konnte darüber hinaus auch nicht durch Coimmunpräzipitation, SDS Gelektrophorese und Detektion beider Proteine durch den Einsatz tag spezifischer Antikörper im Western Blot nachgewiesen werden, was zumindest teilweise auf eine sterische Behinderung der Immunglobuline zurückgeführt werden könnte. Zudem konnte die membranständige Expression des rK2P2.1 Proteins durch Coexpression der rKvß2 Untereinheit nicht erhöht werden. Möglicherweise stellt das funktionelle Zusammenspiel von rK2P2.1 Kanalprotein mit einer akzessorischen rKvβ Untereinheit und die damit verbundene Hyperpolarisation der Zelle ein neuartiges Konzept in der antiepileptischen, neuroprotektiven und/oder antiarrhythmischen Therapie dar. In weiterführenden Studien wird es also weiterhin von Bedeutung sein, den zugrunde liegenden Mechanismus der Kanalaktivierung zu identifizieren.
In einer weiteren Teilstudie der vorliegenden Arbeit konnte nachgewiesen werden, dass alternatives Spleißen als übergeordneter Regulationsmechanismus die alternative Translationsinitiation des humanen hK2P10.1 Kaliumkanals kontrolliert. Dabei konnte gezeigt werden, dass beim alternativen Spleißen durch Rekombination des ersten Exons drei unterschiedliche hK2P10.1 Isoformen (IF) ausgebildet und gewebsspezifisch exprimiert werden (Gehirn: IF1 und IF2; Herz: IF2). Zusätzlich wurde durch alternatives Spleißen die Translationsinitiationssequenz (TIS) vor dem ersten Startcodon verändert. Die biochemischen Western Blot Analysen konnten zweifelsfrei nachweisen, dass die TIS vor dem ersten Startcodon die Translation an den Ribosomen unterschiedlich stark initiiert; dabei handelt es sich nicht um eine posttranslationale Proteinmodifikation. Eine geringe Affinität der TIS für das erste Startcodon kann zum sogenannten “leaky scanning“ führen, wobei der Translationsbeginn an einem weiter “downstream“ positionierten Startcodon stattfindet. Dadurch kam es auch in der vorliegenden Arbeit zur Translation von Kanalproteinen mit unterschiedlicher Länge des N-Terminus. Für jede der drei IFs konnten drei Startcodons im offenen Leseraster identifiziert und mittels Western Blot Analyse biochemisch dargestellt werden. Die mit Hilfe von Xenopus laevis Oozyten gewonnenen Ergebnisse konnten anschließend in HEK293 Zellen bestätigt werden.
Elektrophysiologisch wurden in mit mRNA injizierten Xenopus laevis Oozyten mittels voltage-clamp Technik Stromableitungen und Ruhemembranpotentiale sowohl von Wildtypen aller IFs als auch von homomer aufgebauten ATI-Varianten der ein-zelnen hK2P10.1 IFs aufgezeichnet. Dabei zeigte sich bei den Wildtypen, dass IF2 im Vergleich die größten Stromamplituden aufwies und die Oozyte am wenigstens depolarisiert wurde. Die Gegenüberstellung der Stromamplituden aller ATI-Varian-ten spiegelte zum einen wider, dass diejenigen der Wildtypen aus dem Zusammenspiel aller drei möglichen Kanalproteine bestanden und zum anderen, welches Kanalprotein die Stromamplitude maßgeblich bestimmte. Dabei wiesen die Kanalproteine mit dem kürzesten N-Terminus übereinstimmend bei allen drei IFs deutlich geringere Kaliumströme auf und die entsprechenden Oozyten depolarisierten am stärksten. Die elektrophysiologischen Ergebnisse bestätigten die biochemischen Analysen. Spleißen der mRNA und die alternative Translationsinitiation bestimmen die gewebsspezifische Proteinvariabilität und beeinflussen somit die Feinregulation des Ruhemembranpotentials. IF-abhängige Proteineigenschaften sorgen für eine unterschiedlich ausgeprägte Depolarisation der Zelle. Hierdurch könnte die Entstehung von Arrhythmien begünstigt und daher die gezielte Beeinflussung der Proteinexpression als Ansatz für neue Therapiekonzepte genutzt werden.
In einer dritten Teilstudie sollte der Effekt des nicht-selektiven β-Adrenozeptor Antagonisten Carvedilol auf hK2P2.1 und hK2P10.1 Kanäle sowie deren ATI-Varianten analysiert werden. Neben dem Einsatz als Antihypertonikum wirkt sich die Gabe von Carvedilol bei der Behandlung von Herzinsuffizienz nachweislich prognostisch günstig aus. Darüber hinaus senkt es das Auftreten von Arrhythmien nach Myokardinfarkten und minimiert die Rezidivrate von Vorhofflimmern nach erfolgter Kardioversion.
In mit spezifischer mRNA transfizierten Xenopus laevis Oozyten ließ sich sowohl für den hK2P2.1 als auch den hK2P10.1 Kaliumkanal eine konzentrationsabhängige Inhibition der durch Spannungsimpulse induzierten Stromamplitude durch Carvedilol nachweisen. Der hK2P2.1 Kanal wurde dabei sowohl in geöffnetem als auch geschlossenem Zustand inhibiert und die Inhibition unterlag keiner Frequenzabhängigkeit. Im Vergleich zum Wildtyp zeigten die ATI-Varianten beider Kanäle eine differentielle Sensitivität für Carvedilol. Dabei war übereinstimmend zu registrieren, dass mit Verkürzung des N-Terminus die pharmakologische Sensitivität abnahm. Die dargestellten Ergebnisse liefern Hinweise dafür, dass die antiarrhythmische Wirkung von Carvedilol zumindest teilweise auf die Inhibition kardialer K2P-Kanäle zurückzuführen ist. Außerdem konnte nachgewiesen werden, dass ATI neben der Beeinflussung der Proteinvariabilität und elektrophysiologischer Eigenschaften durch Verkürzung des N-Terminus die Kanalpharmakologie von Carvedilol beeinflusst. Infolge spatiotemporal unterschiedlicher Expressionsmuster der ATI-Varian-ten wäre somit mit unterschiedlichen pharmakologischen Effekten durch den Einsatz von Carvedilol zu rechnen.
Die präsentierten Ergebnisse unterstreichen die Bedeutsamkeit der K2P-Kanäle für die Regulation zellulärer Erregbarkeit. Als feine Stellschrauben können sie die Zelle sowohl hyper- als auch depolarisieren. Im Gesamtkontext der Zellphysiologie oder durch Dysregulation kann somit die Entstehung von Arrhythmien begünstigt oder verhindert werden. Gleichzeitig bietet dieses Verständnis Ansätze für neuartige Therapiekonzepte. Die vorgestellten Regulationsmechanismen stellen die Basis für das Verständnis funktioneller Eigenschaften von K2P2.1 und K2P10.1 Kanälen dar, bedürfen aber weiterführender Studien, um Zusammenhänge zu Physiologie und Pathophysiologie der K2P-Kanäle herzustellen. The ion channels K2P2.1 and K2P10.1 represent members of the two-pore-domain potassium (K2P) channel family. Beside their predominant expression in neuronal tissue, they were also detected in cardiac myocytes. K2P channels stabilize the resting membrane potential and facilitate action potential repolarization. Polymodal regulation by chemical and physical stimuli, G-protein coupled receptor pathways and specific protein binding partners modulates the channel properties and results in quantitative and qualitative expression pattern. The regulation of K2P currents represents a control mechanism to determine cellular excitability. This study presents novel mechanisms of both human and rat specific K2P2.1 and K2P10.1 potassium channel regulation, employing electrophysiological and biochemical approaches primarily in Xenopus laevis oocytes but also human HEK293 cells.
Auxiliary β subunits were previously assumed to selectively associate with voltage-gated potassium channels. In the present work, the rat specific ß subunits rKvβ1 - rKvβ4 were shown to interact functionally with rK2P2.1 potassium channels. In the presence of rKvβ2 protein, rK2P2.1 channel currents increased in a concentration- and time-dependent manner and significantly hyperpolarized the resting mem- brane potential. Also co-expression of rKvβ1, rKvβ3 and rKvβ4 similarly induced concentration-dependent rK2P2.1 current enhancement. In addition, a minor but significant reduction in half maximal activation voltage in the presence of rKvß2 expression could be calculated. Co-expression of rKvβ2 and rK2P2.1 ATI variants (rK2P2.1 M57I, rK2P2.1 Δ1-56) did not provide distinct evidence for the involvement of the N-terminus in functional interaction. Neither an increased surface protein expression nor a stable rK2P2.1 interaction with rKvß2, assessed by co-immuno-precipitation assays, could be identified as underlying molecular mechanism. The rKvβ2 mediated increase in rK2P2.1 currents and associate resting membrane potential hyperpolarization imply a potential novel antiepileptic, neuroprotective or antiarrhythmic concept. Reduced or absent expression of rK2P2.1 or the loss of rKvβ2 may account for the development of epilepsy and mental disorders in vivo.
In another partial study of the present work it could be demonstrated that alternative mRNA splicing as overall regulatory mechanism determines translation initiation and contributes to protein diversity and function of hK2P10.1. Through recombination of the first exon, alternative splicing of hK2P10.1 mRNA produces three different transcript variants (isoforms), which were expressed in a tissue-specific manner (brain: isoform 1 and 2; heart: isoform 2). Additionally alternative splicing regulates translation start site by recombination a short nucleotide sequence (translation initiation sequence, TIS, Kozak sequence) preceeding the first start codon. Western blot analysis of Xenopus laevis oocyte lysates confirmed differential translation initiation at the first start codon due to a strong or weak TIS; this doesn’t represent posttranslational protein modification. If the first start codon is surrounded by a weak nucleotide context it may be resulted in leaky scanning and translation starts at a downstream position. Alternative translation initiation (ATI) generates protein subunits, which differ in their N-terminal length. For each isoform, three start codons could be detected in the open reading frame revealed by Western blot analysis. Biochemical key observations from mRNA expression in Xenopus laevis oocytes were extended to cDNA expression in human embryonic kidney cells and resembled the previous findings.
Using the two-electrode voltage clamp technique, potassium currents and resting membrane potentials of hK2P10.1 isoform wild types and homomeric ATI variants were recorded to study electrophysiological properties. In comparison to the other channel wild type forms, hK2P10.1 isoform 2 yielded currents with the greatest magnitude and associated oocyte hyperpolarization. Expression of single subunits of ATI variants reflected the current composition in K2P10.1 isoform wild types. In all three isoforms ATI variants with most severely truncated N-terminus displayed distinct reduced outward currents and depolarizing resting membrane potentials. These electrophysiological results were confirmed by the biochemical observa-tions.
Messenger RNA splicing and alternative translation initiation determine tissue-specific protein variability and regulate cell excitability. Isoform-dependent effects on K2P10.1 currents were accompanied by changes in resting membrane potential, which could promote the development of arrhythmias or could be used as novel concept of therapy by selective protein expression.
Finally, the effect of the non-selective β-receptor antagonist carvedilol on hK2P2.1, hK2P10.1 and their ATI variants was examined. In addition to the clinical use in patients with hypertension, carvedilol improves the clinical outcome in heart failure patients. Carvedilol decreases the occurrence of arrhythmias after myocard infarction and minimizes the recurrence of atrial fibrillation after cardioversion. As previously reported for hK2P3.1, carvedilol also inhibited hK2P2.1 and hK2P10.1 potassium currents in Xenopus laevis oocytes in a concentration-dependent manner. In contrast to K2P3.1 the derived IC50 value did not reach clinical plasma concentrations. The inhibition of the hK2P2.1 channel was neither state- nor frequency-dependent. Compared with full-length K2P channels, truncated isoforms of hK2P2.1 and hK2P10.1 produced by ATI were differentially regulated by carvedilol. N terminal shortened ATI variants displayed reduced sensitivity to carvedilol.
The results provide evidence for the contribution of K2P channel inhibition to the antiarrhythmic effect of carvedilol. In addition to increasing protein diversity and controlling electrophysiological channel properties by truncated N-terminus, this work identifies ATI as a genetic mechanism regulating sensitivity of hK2P2.1 and hK2P10.1 channels to carvedilol. Differential expression of ATI-dependent K2P channel variants may result in spatiotemporal variation of electrophysiological carvedilol effects in the heart.
The findings from this work confirm the significance of K2P channels for the regulation of cellular excitability. Activation or inhibition results in cell hyper- or depolarization. In the context of cell physiology or in case of dysregulation, cardiac arrhythmias may be triggered or prevented. These findings provide novel approa-ches for the treatment of arrhythmias. The regulatory mechanisms identified here represent the basis for understanding functional properties of K2P2.1 and K2P10.1 potassium channels. Further investigation is needed to assess the role of K2P channel regulation in physiology and disease.
| Erscheinungsdatum | 28.04.2021 |
|---|---|
| Reihe/Serie | Edition Scientifique |
| Verlagsort | Gießen |
| Sprache | deutsch |
| Maße | 148 x 210 mm |
| Gewicht | 550 g |
| Themenwelt | Veterinärmedizin ► Vorklinik |
| Schlagworte | Biochemie • Doktorarbeit • Tiermedizin |
| ISBN-10 | 3-8359-6938-2 / 3835969382 |
| ISBN-13 | 978-3-8359-6938-4 / 9783835969384 |
| Zustand | Neuware |
| Informationen gemäß Produktsicherheitsverordnung (GPSR) | |
| Haben Sie eine Frage zum Produkt? |
Mehr entdecken
aus dem Bereich
aus dem Bereich
A Color Atlas and Interpretation Guide
Buch | Hardcover (2022)
Saunders (Verlag)
165,80 €