Charakterisierung der Interaktion zwischen HBV/HDV und dem spezifischen Rezeptor NTCP durch die Identifizierung von Protein-Protein Interaktionen und Interaktionsdomänen
Seiten
2022
VVB Laufersweiler Verlag
978-3-8359-7044-1 (ISBN)
VVB Laufersweiler Verlag
978-3-8359-7044-1 (ISBN)
- Keine Verlagsinformationen verfügbar
- Artikel merken
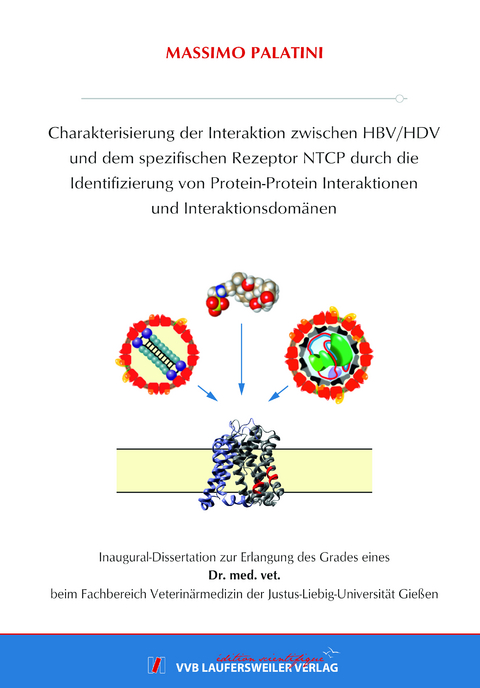
Das Na+/Taurocholate Cotransporting Polypeptide (NTCP, Gensymbol: SLC10A1) stellt das erste und am besten charakterisierte Mitglied der SLC10 Proteinfamilie dar, zu der aktuell sieben Transmembranproteine zählen. Neben der physiologischen Funktion als exklusiv in der Leber exprimierter Gallensäuretransporter, erfüllt das NTCP zusätzlich eine Funktion als hochspezifischer Rezeptor für das Hepatitis B (HBV) und Hepatitis D (HDV) Virus. Beide Viren sind durch eine identische Virushülle gekennzeichnet und werden daher mittels Endozytose nach NTCP-Bindung in Leberzellen aufgenommen.
Für die SLC10 Proteinfamilie konnte als gemeinsames Charakteristikum gefunden werden, Homo-, sowie Heterodimere mit anderen Mitgliedern derselben Proteinfamilie zu bilden, was vor allem durch das Membrane Yeast-Two Hybrid (MYTH) System in Hefezellen untersucht und partiell durch die Co-Immunpräzipitation (Co-IP) in humanen HEK293-Zellen bestätigt wurde. Eine Proteinsequenzanalyse der SLC10 Proteine ergab sowohl ein konserviertes GXXXG Motiv in der siebten, als auch ein partiell konserviertes GXXXG/A Motiv in der zweiten Transmembrandomäne. Diese Motive sind bereits seit der Entdeckung im humanen Glycophorin A im Jahre 1992 als Dimerisierungsmotive in einer Vielzahl von dimerisierenden Proteinen bekannt. Durch Mutation dieser Motive im NTCP konnte im MYTH-System eine Reduktion der Dimerisierung beobachtet werden, was jedoch nicht durch eine Co-IP bestätigt werden konnte. Co-Lokalisationsversuche mit dem Wildtyp-NTCP, sowie Transportexperimente mit Taurocholat bestätigten eine Loss-of-function-Mutation im Falle der Mutante G233XXXG237, sowie ein dem Wildtyp ähnliches Verhalten für die Mutante G60XXXA64. Zusätzlich zeigte sich im Vergleich zum Wildtyp-NTCP eine signifikant niedrigere HBV-Infektionsrate in Zellen, die mit der Mutante G60XXXA64 transfiziert wurden. Da die Dimerisierung des NTCP als essentieller Faktor für eine erfolgreiche Endozytose des HBV angesehen wird, ist es möglich, dass die Mutante G60XXXA64 aufgrund einer niedrigeren NTCP-Dimerisierungsfähigkeit die HBV-Infektion hemmt. Allerdings deuten die Daten auch darauf hin, dass die untersuchten GXXXG/A Motive für eine korrekte Faltung und das Sorting in die Plasmamembran vom NTCP wichtig sind.
Im Rahmen eines MYTH-System-Screenings, mit dem Ziel, Proteininteraktionspartner des NTCP aus einer cDNA-Bibliothek aus der humanen Niere zu identifizieren, konnte als häufigster Treffer das IFITM3 gefunden werden. Dieses spielt für die angeborene Immunität eine große Rolle und ist als viraler Restriktionsfaktor bekannt. In den beiden humanen Leberzelllinien HepG2 und HuH7 konnte die Interaktion zwischen IFITM3 und NTCP mittels Co-IP bestätigt werden. Durch siRNA-vermittelte Knockdown-Experimente konnte mit hoher Effizienz die Expression des IFITM3 gehemmt werden, um die Auswirkungen auf dem NTCP zu untersuchen. Dabei zeigte sich, dass in den HepG2-Zellen eine verminderte IFITM3-Expression gleichzeitig eine erniedrigte NTCP-Expression auf Gen- und Proteinebene nach sich zog, sowie eine verminderte Transportrate von Taurocholat. IFITM3 könnte also als NTCP-stabilisierender Faktor fungieren. In HuH7-Zellen und primären humanen Hepatozyten konnte zudem gezeigt werden, dass IFITM3 die Infektion mit HBV/HDV zu unterstützen scheint. Zumindest war die Infektion nach Knockdown von IFITM3 deutlich gehemmt. Aufgrund der Tatsache, dass sich die Bindung des myr-PreS1-Peptids unter Knockdown des IFITM3 quantitativ nicht von der Kontrolle signifikant unterschied, scheint sich die Interaktion zwischen IFITM3 und HBV/HDV erst nach der Bindung am NTCP abzuspielen. Aufgrund der physiologischen Lokalisation des IFITM3 in der Membran von Endolysosomen ist es denkbar, dass HBV/HDV und IFITM3 innerhalb der Endosomen nach der Endozytose derart interagieren, dass es zu einer stärkeren Infektion kommt, allerdings sind weitere Untersuchungen nötig, um den exakten Mechanismus aufzudecken, welcher dieser Beobachtung zu Grunde liegt. Auf Grundlage der ermittelten Daten scheint es möglich durch Blockade von IFITM3, z.B. durch Rapamycin oder Amphotericin B, die HBV-/ HDV-Infektion von Leberzellen zu begrenzen, die Folge wäre jedoch das Aufsteigen anderer viraler Infektionen, die physiologischerweise durch IFITM3 gehemmt werden. Na+/Taurocholate Cotransporting Polypeptide (NTCP, gene symbol SLC10A1) represents the first and best characterized member of the SLC10 carrier family, which currently consists of seven transmembrane proteins. In addition to its physiological function as a hepatic bile acid transporter NTCP was identified as the high affinity entry receptor of the hepatitis B (HBV) and hepatitis D (HDV) viruses.
It was shown that homodimerization and heterodimerization within members of the SLC10 carrier family is a typical feature of this protein family. This was experimentally analyzed and confirmed by Membrane Yeast-Two Hybrid (MYTH) experiments in yeast cells and was partially confirmed by co-immunoprecipitation (co-IP) in human HEK293 cells. Protein sequence analysis of the SLC10 proteins revealed both a conserved GlycineXXXGlycine (GXXXG) motif in the seventh, and a partially conserved GXXXG/Alanine (GXXXA) motif in the second transmembrane domain (TMD2/7). Such motifs have previously been analyzed and identified in several other dimerizing proteins. Mutation of these motifs in NTCP resulted in a reduction of dimerization observed in the MYTH-system, which could however not be confirmed by co-IP. Co-localization experiments with wild-type NTCP, as well as transport experiments with taurocholate, confirmed a loss-of-function mutation in the case of the TMD7 mutant. In contrast, the TMD2 mutant behaved quite similar to the wild-type NTCP and showed plasma membrane expression and only slightly decreased transport activity. In addition, a significantly lower HBV-infection rate was shown in cells transfected with the TMD2 NTCP mutant compared with wild-type NTCP. Because dimerization of NTCP is considered an essential factor for successful endocytosis of HBV, it is possible that the TMD2 mutant inhibits HBV-infection due to a lower NTCP dimerization ability. However, the data of the present study suggest that the GXXXG/A motifs of NTCP are more important for correct folding of NTCP and its sorting to the plasma membrane.
During MYTH-screening of a kidney cDNA library with the aim of identifying novel protein interaction partners of NTCP, IFITM3 was found as the most dominant hit. IFITM3 plays a role in the innate immunity and is known as a viral restriction factor. In the two human liver cell lines HepG2 and HuH7, the interaction between IFITM3 and NTCP was confirmed by means of co-IP. SiRNA-mediated knockdown experiments confirmed a successful IFITM3-knockdown with high efficiency in hepatoma cells and primary human hepatocytes (PHH). It was found that in the HepG2-cells, decreased IFITM3-expression simultaneously resulted in decreased NTCP-expression at the gene and protein level, as well as a reduced transport rate of taurocholate. Based on this, IFITM3 could act as an NTCP-stabilizing factor. In HuH7-cells and PHH, IFITM3 has been shown to support infection with HBV/HDV. Infection with both viruses was significantly inhibited after knockdown of IFITM3. Due to the fact that the binding of the myr-preS1-peptide under knockdown of IFITM3 did not differ quantitatively from the control, the interaction between IFITM3 and HBV/HDV appears to take place only after binding of HBV/HDV to NTCP. Due to the physiological localization of IFITM3 in the membrane of endolysosomes, it is conceivable that HBV/HDV and IFITM3 interact within the endosomes after endocytosis in such a way that a stronger infection occurs. However, further investigations are needed to uncover the exact mechanism underlying this observation. Based on the data obtained, it seems possible to limit HBV-/ HDV-infection of liver cells by blocking IFITM3, e.g. by rapamycin or amphotericin B. However, blocking IFITM3 would lead to a higher susceptibility of other viral infections which would physiologically be restricted by IFITM3.
Für die SLC10 Proteinfamilie konnte als gemeinsames Charakteristikum gefunden werden, Homo-, sowie Heterodimere mit anderen Mitgliedern derselben Proteinfamilie zu bilden, was vor allem durch das Membrane Yeast-Two Hybrid (MYTH) System in Hefezellen untersucht und partiell durch die Co-Immunpräzipitation (Co-IP) in humanen HEK293-Zellen bestätigt wurde. Eine Proteinsequenzanalyse der SLC10 Proteine ergab sowohl ein konserviertes GXXXG Motiv in der siebten, als auch ein partiell konserviertes GXXXG/A Motiv in der zweiten Transmembrandomäne. Diese Motive sind bereits seit der Entdeckung im humanen Glycophorin A im Jahre 1992 als Dimerisierungsmotive in einer Vielzahl von dimerisierenden Proteinen bekannt. Durch Mutation dieser Motive im NTCP konnte im MYTH-System eine Reduktion der Dimerisierung beobachtet werden, was jedoch nicht durch eine Co-IP bestätigt werden konnte. Co-Lokalisationsversuche mit dem Wildtyp-NTCP, sowie Transportexperimente mit Taurocholat bestätigten eine Loss-of-function-Mutation im Falle der Mutante G233XXXG237, sowie ein dem Wildtyp ähnliches Verhalten für die Mutante G60XXXA64. Zusätzlich zeigte sich im Vergleich zum Wildtyp-NTCP eine signifikant niedrigere HBV-Infektionsrate in Zellen, die mit der Mutante G60XXXA64 transfiziert wurden. Da die Dimerisierung des NTCP als essentieller Faktor für eine erfolgreiche Endozytose des HBV angesehen wird, ist es möglich, dass die Mutante G60XXXA64 aufgrund einer niedrigeren NTCP-Dimerisierungsfähigkeit die HBV-Infektion hemmt. Allerdings deuten die Daten auch darauf hin, dass die untersuchten GXXXG/A Motive für eine korrekte Faltung und das Sorting in die Plasmamembran vom NTCP wichtig sind.
Im Rahmen eines MYTH-System-Screenings, mit dem Ziel, Proteininteraktionspartner des NTCP aus einer cDNA-Bibliothek aus der humanen Niere zu identifizieren, konnte als häufigster Treffer das IFITM3 gefunden werden. Dieses spielt für die angeborene Immunität eine große Rolle und ist als viraler Restriktionsfaktor bekannt. In den beiden humanen Leberzelllinien HepG2 und HuH7 konnte die Interaktion zwischen IFITM3 und NTCP mittels Co-IP bestätigt werden. Durch siRNA-vermittelte Knockdown-Experimente konnte mit hoher Effizienz die Expression des IFITM3 gehemmt werden, um die Auswirkungen auf dem NTCP zu untersuchen. Dabei zeigte sich, dass in den HepG2-Zellen eine verminderte IFITM3-Expression gleichzeitig eine erniedrigte NTCP-Expression auf Gen- und Proteinebene nach sich zog, sowie eine verminderte Transportrate von Taurocholat. IFITM3 könnte also als NTCP-stabilisierender Faktor fungieren. In HuH7-Zellen und primären humanen Hepatozyten konnte zudem gezeigt werden, dass IFITM3 die Infektion mit HBV/HDV zu unterstützen scheint. Zumindest war die Infektion nach Knockdown von IFITM3 deutlich gehemmt. Aufgrund der Tatsache, dass sich die Bindung des myr-PreS1-Peptids unter Knockdown des IFITM3 quantitativ nicht von der Kontrolle signifikant unterschied, scheint sich die Interaktion zwischen IFITM3 und HBV/HDV erst nach der Bindung am NTCP abzuspielen. Aufgrund der physiologischen Lokalisation des IFITM3 in der Membran von Endolysosomen ist es denkbar, dass HBV/HDV und IFITM3 innerhalb der Endosomen nach der Endozytose derart interagieren, dass es zu einer stärkeren Infektion kommt, allerdings sind weitere Untersuchungen nötig, um den exakten Mechanismus aufzudecken, welcher dieser Beobachtung zu Grunde liegt. Auf Grundlage der ermittelten Daten scheint es möglich durch Blockade von IFITM3, z.B. durch Rapamycin oder Amphotericin B, die HBV-/ HDV-Infektion von Leberzellen zu begrenzen, die Folge wäre jedoch das Aufsteigen anderer viraler Infektionen, die physiologischerweise durch IFITM3 gehemmt werden. Na+/Taurocholate Cotransporting Polypeptide (NTCP, gene symbol SLC10A1) represents the first and best characterized member of the SLC10 carrier family, which currently consists of seven transmembrane proteins. In addition to its physiological function as a hepatic bile acid transporter NTCP was identified as the high affinity entry receptor of the hepatitis B (HBV) and hepatitis D (HDV) viruses.
It was shown that homodimerization and heterodimerization within members of the SLC10 carrier family is a typical feature of this protein family. This was experimentally analyzed and confirmed by Membrane Yeast-Two Hybrid (MYTH) experiments in yeast cells and was partially confirmed by co-immunoprecipitation (co-IP) in human HEK293 cells. Protein sequence analysis of the SLC10 proteins revealed both a conserved GlycineXXXGlycine (GXXXG) motif in the seventh, and a partially conserved GXXXG/Alanine (GXXXA) motif in the second transmembrane domain (TMD2/7). Such motifs have previously been analyzed and identified in several other dimerizing proteins. Mutation of these motifs in NTCP resulted in a reduction of dimerization observed in the MYTH-system, which could however not be confirmed by co-IP. Co-localization experiments with wild-type NTCP, as well as transport experiments with taurocholate, confirmed a loss-of-function mutation in the case of the TMD7 mutant. In contrast, the TMD2 mutant behaved quite similar to the wild-type NTCP and showed plasma membrane expression and only slightly decreased transport activity. In addition, a significantly lower HBV-infection rate was shown in cells transfected with the TMD2 NTCP mutant compared with wild-type NTCP. Because dimerization of NTCP is considered an essential factor for successful endocytosis of HBV, it is possible that the TMD2 mutant inhibits HBV-infection due to a lower NTCP dimerization ability. However, the data of the present study suggest that the GXXXG/A motifs of NTCP are more important for correct folding of NTCP and its sorting to the plasma membrane.
During MYTH-screening of a kidney cDNA library with the aim of identifying novel protein interaction partners of NTCP, IFITM3 was found as the most dominant hit. IFITM3 plays a role in the innate immunity and is known as a viral restriction factor. In the two human liver cell lines HepG2 and HuH7, the interaction between IFITM3 and NTCP was confirmed by means of co-IP. SiRNA-mediated knockdown experiments confirmed a successful IFITM3-knockdown with high efficiency in hepatoma cells and primary human hepatocytes (PHH). It was found that in the HepG2-cells, decreased IFITM3-expression simultaneously resulted in decreased NTCP-expression at the gene and protein level, as well as a reduced transport rate of taurocholate. Based on this, IFITM3 could act as an NTCP-stabilizing factor. In HuH7-cells and PHH, IFITM3 has been shown to support infection with HBV/HDV. Infection with both viruses was significantly inhibited after knockdown of IFITM3. Due to the fact that the binding of the myr-preS1-peptide under knockdown of IFITM3 did not differ quantitatively from the control, the interaction between IFITM3 and HBV/HDV appears to take place only after binding of HBV/HDV to NTCP. Due to the physiological localization of IFITM3 in the membrane of endolysosomes, it is conceivable that HBV/HDV and IFITM3 interact within the endosomes after endocytosis in such a way that a stronger infection occurs. However, further investigations are needed to uncover the exact mechanism underlying this observation. Based on the data obtained, it seems possible to limit HBV-/ HDV-infection of liver cells by blocking IFITM3, e.g. by rapamycin or amphotericin B. However, blocking IFITM3 would lead to a higher susceptibility of other viral infections which would physiologically be restricted by IFITM3.
| Erscheinungsdatum | 20.07.2022 |
|---|---|
| Reihe/Serie | Edition Scientifique |
| Verlagsort | Gießen |
| Sprache | deutsch |
| Maße | 148 x 210 mm |
| Gewicht | 170 g |
| Themenwelt | Medizin / Pharmazie |
| Veterinärmedizin | |
| Schlagworte | Gallensäure • HBV Infektion • Hepatitis |
| ISBN-10 | 3-8359-7044-5 / 3835970445 |
| ISBN-13 | 978-3-8359-7044-1 / 9783835970441 |
| Zustand | Neuware |
| Informationen gemäß Produktsicherheitsverordnung (GPSR) | |
| Haben Sie eine Frage zum Produkt? |
Mehr entdecken
aus dem Bereich
aus dem Bereich
Buch | Hardcover (2024)
Referenz-Verlag
58,00 €
Buch | Softcover (2023)
Standard Systeme (Verlag)
22,90 €