Charakterisierung der pyrogenen Wirkung der synthetischen doppelsträngigen RNA Polyinosin-Polycytidylsäure (Poly I:C)
Seiten
2021
VVB Laufersweiler Verlag
978-3-8359-6978-0 (ISBN)
VVB Laufersweiler Verlag
978-3-8359-6978-0 (ISBN)
- Keine Verlagsinformationen verfügbar
- Artikel merken
Zentrales Ziel des ersten Teils der vorgelegten Dissertationsschrift war die Chrakterisierung von Polyinosin : Polycytosin (PIPC) als exogenes Pyrogen beim Meerschweinchen. Bei PIPC handelt es sich um eine synthetischen doppelstängige RNA, die als Agonist des Toll-like Rezeptors-3 wirkt. Es wurde untersucht, wie sich die Art der Applikation von PIPC auf die Fieberentwicklung und die Bildung ausgewählter Zytokine bei der untersuchten Spezies auswirkt. Die Körperkerntemperatur wurde bei frei beweglichen Tieren mittels Radiotelemtrie erfasst, die Zytokine Tumor Nekrose Faktor- (TNF-) und Interleukin-6 (IL-6) wurden im Blutplasma mittles spezifischer Bioassays gemessen. Bei einer Dosis von 500 µg/kg hing die fiebererzeugende Wirkung von PIPC sehr star von der Art der Applikation des Pyrogens ab. Intra-arterielle (i.a.) oder intraperitoneale (i.p.) Injektionen von PIPC induzierten starke Fieberreaktionen und verursachten hohe zirkulierende Konzentrationen an TNF- und IL-6. Intramuskuläre (i.m.) Injektionen des synthetischen Pyrogens induzierten nur mäßiges Fieber und geringfügige Anstiege an Zytokinen im Blut. Nach Injektionen von PIPC in sukutan (s.c.) impalntierte Kammern aus Teflon traten weder Fieber noch Anstiege der untersuchten Zytokine im Plutplasma der Versuchstiere auf. Wurde PIPC in Abständen von 3 Tagen 5-mal wiederholt injiziert, entwickelten sich jeweil ähnliche Fieberveräufe und Zytokinmuster im Blut. Jedoch war die Stärke beider Antworten bei wiederholten Stimulationen mit PIPC, im Vergleich zu den Reaktionen auf die erste Injektion, signifikant abgeschwächt. Es scheint sich somit eine partielle Entwicklung einer Toleranz bei wiederholter Konfrontation der Versuchstiere mit PIPC gegenüber diesem Pyrogen zu manifestieren. Die Modulation der Stärke des PIPC-induzierten Fiebers durch die Art der Applikation und die partielle Toleranzentwicklung korreliert somit mit dem Ausmaß der PIPC-induzierten Bildung der beiden untersuchten Zytokine.
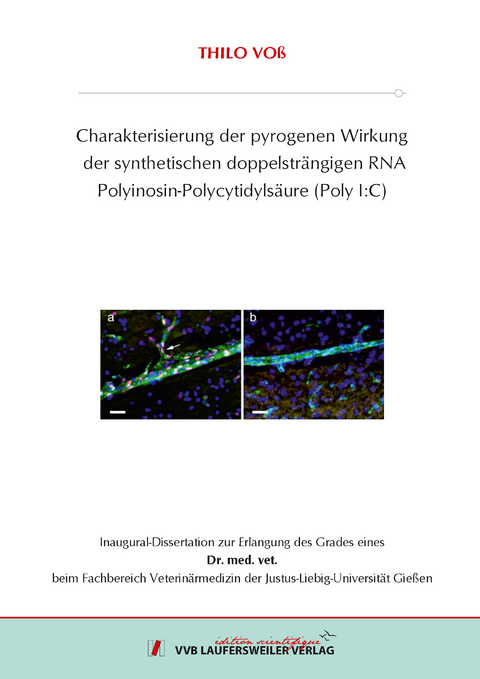
Im zweiten Teil dieses Dissertationsprojekts wurde die direkte Auswirkung von i.a. Injektionen des synthetischen Pyrogens PIPC (500 µg/kg) auf mögliche Mechanismen der Fieberentstehung im Gehirn des Meerschweinchens experimentell untersucht. Die bei dieser Dosierung und dieser Applikationsart auftretende starke Fieberreaktion wurde durch eine Behandlung mit dem nicht-selektiven Zyklooxygenase (COX)-Hemmer Diclofenac vollständig unterdrückt, durch den selektiven COX-2-Hemmer Nimesulide teilweise abgeschwächt (Dosierung jeweils 5 mg/kg). Es wurde weiterhin untersucht, ob eine direkte Aktivierung von Gehirnzellen / strukturen während der durch PIPC induziertzen Fieberreaktion nachweisbar war. Mittels radioaktiver in situ Hybridisierung wurde eine erhöhte Expression von COX-2 und IL-1 mRNA in spezifischen Regionen des Gehirns der mit PIPC behandelten Meerschweinchen dokumentiert. Die COX-2-Signale waren hierbei hauptsächlich mit Blutgefäßen assoziiert. Injektionen von PIPC (500 µg/kg, i.a.) verursachten außerdem eine massive Translokation des inflammatorischen Transkriptionsfaktors STAT3 in die Kerne bestimmter Zellen in bestimmten Hirnstrukturen. Speziell waren STAT3-aktivierte Endothelzellen in zahlreichen Hirnarealen feststellbar. Zusätzlich wurden Populationen STAT3-aktivierter Astrozyten in Gehirnstrukturen mit unvollständiger Blut-Hirn-Schranke nachgewiesen. Hierbei handelte es sich vornehmlich um die sensorischen zirkumventrikulären Organe (Area postrema, Organum vasculosum laminae terminalis und Organum Subfornicale). Für eine weitere kleine Population STAT3-aktivierter Gehirnzellen konnte der zelluläre Phänotyp noch nicht identifiziert werden. Der Toll-like Rezeptor-3 Agonist PIPC verursacht somit beim Meerschweinchen ein Aktivierungsmuster von Gehirnstrukturen, wie es auch in anderen Experimentalmodellen einer systemischen Entzündungsreaktion bei anderen Spezies beschrieben wurde. The aim of the first part of this thesis was to characterize the properties of polyinosinic : polycytidylic acid (PIPC), a synthetic double stranded RNA and Toll-like receptor 3 agonist, to induce fever and circulating cytokines in guinea pigs. Special emphasis was directed to the route of PIPC administration and on a putative development of tolerance to this pyrogen. Changes in abdominal temperature were recorded in unrestrained animals by use of intra-abdominally implanted radiotransmitters. Circulating concentrations of tumor necrosis factor-a (TNF-) and interleukin-6 (IL-6) were measured by use of specific bioassays. The pyrogenic effect of PIPC at a dose of 500 µg/kg depended on the route of its administration. Intra-arterial (i.a.) or intraperitoneal (i.p.) injections of PIPC induced pronounced fevers and strong elevations of circulating TNF- and IL-6. Intramuscular (i.m.) injections of the synthetic pyrogen caused rather moderate febrile and cytokine responses. Administration of PIPC into artificial subcutaneously (s.c.) implanted Teflon chambers had no pyrogenic and cytokine-inducing effects. I.a. injections of PIPC, repeated five times at intervals of 3 days, resulted in fevers of similar shape and duration and similar cytokine response patterns. However, the strength of fever and cytokine formation was significantly reduced, although not abolished, in response to the repeated injections compared with the first injection, indication a partial development of tolerance to repeated stimulations with PIPC. The modulation of the strength of PIPC-induced fever, dependent on the route of administration, or the state of partial tolerance to this pyrogen, may thus be related to the formation of pyrogenic cytokines.
In the second part of this thesis the effects of i.a. injections of 500 µg/kg PIPC on fever-inducing mechanisms in the brain were investigated. The pronounced fever, which was evoked by this dose of the pyrogen, was completely abolished by treatment with the non-selective cyclooxygenase (COX) inhibitor diclofenac and, in part, attenuated by the administration of the selective COX-2 inhibitor nimesulide (dose: 5 mg/kg for both COX-inhibitors). It was further investigated whether direct activation of brain cells during PIPC-induced fever could be demonstrated. Using radioactive in situ hybridization, it could be demonstrated that treatment with PIPC resulted in an upregulation of COX-2 and IL-1 mRNA in specific areas of the guinea pig brain. Thus, COX-2-specific hybridization signals seemed to be mainly associated with brain blood vessels. I.a. injections of PIPC further induced the pronounced nuclear translocation of the inflammatory transcription factor STAT3 in the endothelium of various fore- and hindbrain areas and in the meninges. In brain structures that lack a tight blood-brain barrier, i.e. the sensory circumventricular organs (area postrema, vascular organ of lamina terminalis, subfornical organ), the astrocyters and a population of still undetermined cellular phenotype also showed marked STAT3 activation in response to PIPC. The Toll-like receptor-3 agonist PIPC therefore caused a similar activation pattern of brain cells as that reported for other experimental models of systemic inflammation.
Im zweiten Teil dieses Dissertationsprojekts wurde die direkte Auswirkung von i.a. Injektionen des synthetischen Pyrogens PIPC (500 µg/kg) auf mögliche Mechanismen der Fieberentstehung im Gehirn des Meerschweinchens experimentell untersucht. Die bei dieser Dosierung und dieser Applikationsart auftretende starke Fieberreaktion wurde durch eine Behandlung mit dem nicht-selektiven Zyklooxygenase (COX)-Hemmer Diclofenac vollständig unterdrückt, durch den selektiven COX-2-Hemmer Nimesulide teilweise abgeschwächt (Dosierung jeweils 5 mg/kg). Es wurde weiterhin untersucht, ob eine direkte Aktivierung von Gehirnzellen / strukturen während der durch PIPC induziertzen Fieberreaktion nachweisbar war. Mittels radioaktiver in situ Hybridisierung wurde eine erhöhte Expression von COX-2 und IL-1 mRNA in spezifischen Regionen des Gehirns der mit PIPC behandelten Meerschweinchen dokumentiert. Die COX-2-Signale waren hierbei hauptsächlich mit Blutgefäßen assoziiert. Injektionen von PIPC (500 µg/kg, i.a.) verursachten außerdem eine massive Translokation des inflammatorischen Transkriptionsfaktors STAT3 in die Kerne bestimmter Zellen in bestimmten Hirnstrukturen. Speziell waren STAT3-aktivierte Endothelzellen in zahlreichen Hirnarealen feststellbar. Zusätzlich wurden Populationen STAT3-aktivierter Astrozyten in Gehirnstrukturen mit unvollständiger Blut-Hirn-Schranke nachgewiesen. Hierbei handelte es sich vornehmlich um die sensorischen zirkumventrikulären Organe (Area postrema, Organum vasculosum laminae terminalis und Organum Subfornicale). Für eine weitere kleine Population STAT3-aktivierter Gehirnzellen konnte der zelluläre Phänotyp noch nicht identifiziert werden. Der Toll-like Rezeptor-3 Agonist PIPC verursacht somit beim Meerschweinchen ein Aktivierungsmuster von Gehirnstrukturen, wie es auch in anderen Experimentalmodellen einer systemischen Entzündungsreaktion bei anderen Spezies beschrieben wurde. The aim of the first part of this thesis was to characterize the properties of polyinosinic : polycytidylic acid (PIPC), a synthetic double stranded RNA and Toll-like receptor 3 agonist, to induce fever and circulating cytokines in guinea pigs. Special emphasis was directed to the route of PIPC administration and on a putative development of tolerance to this pyrogen. Changes in abdominal temperature were recorded in unrestrained animals by use of intra-abdominally implanted radiotransmitters. Circulating concentrations of tumor necrosis factor-a (TNF-) and interleukin-6 (IL-6) were measured by use of specific bioassays. The pyrogenic effect of PIPC at a dose of 500 µg/kg depended on the route of its administration. Intra-arterial (i.a.) or intraperitoneal (i.p.) injections of PIPC induced pronounced fevers and strong elevations of circulating TNF- and IL-6. Intramuscular (i.m.) injections of the synthetic pyrogen caused rather moderate febrile and cytokine responses. Administration of PIPC into artificial subcutaneously (s.c.) implanted Teflon chambers had no pyrogenic and cytokine-inducing effects. I.a. injections of PIPC, repeated five times at intervals of 3 days, resulted in fevers of similar shape and duration and similar cytokine response patterns. However, the strength of fever and cytokine formation was significantly reduced, although not abolished, in response to the repeated injections compared with the first injection, indication a partial development of tolerance to repeated stimulations with PIPC. The modulation of the strength of PIPC-induced fever, dependent on the route of administration, or the state of partial tolerance to this pyrogen, may thus be related to the formation of pyrogenic cytokines.
In the second part of this thesis the effects of i.a. injections of 500 µg/kg PIPC on fever-inducing mechanisms in the brain were investigated. The pronounced fever, which was evoked by this dose of the pyrogen, was completely abolished by treatment with the non-selective cyclooxygenase (COX) inhibitor diclofenac and, in part, attenuated by the administration of the selective COX-2 inhibitor nimesulide (dose: 5 mg/kg for both COX-inhibitors). It was further investigated whether direct activation of brain cells during PIPC-induced fever could be demonstrated. Using radioactive in situ hybridization, it could be demonstrated that treatment with PIPC resulted in an upregulation of COX-2 and IL-1 mRNA in specific areas of the guinea pig brain. Thus, COX-2-specific hybridization signals seemed to be mainly associated with brain blood vessels. I.a. injections of PIPC further induced the pronounced nuclear translocation of the inflammatory transcription factor STAT3 in the endothelium of various fore- and hindbrain areas and in the meninges. In brain structures that lack a tight blood-brain barrier, i.e. the sensory circumventricular organs (area postrema, vascular organ of lamina terminalis, subfornical organ), the astrocyters and a population of still undetermined cellular phenotype also showed marked STAT3 activation in response to PIPC. The Toll-like receptor-3 agonist PIPC therefore caused a similar activation pattern of brain cells as that reported for other experimental models of systemic inflammation.
| Erscheinungsdatum | 10.01.2022 |
|---|---|
| Reihe/Serie | Edition Scientifique |
| Verlagsort | Gießen |
| Sprache | deutsch |
| Maße | 148 x 210 mm |
| Gewicht | 220 g |
| Themenwelt | Studium ► 2. Studienabschnitt (Klinik) ► Humangenetik |
| Veterinärmedizin ► Allgemein | |
| Schlagworte | Fieber • Ribonukleinsäure • RNS • Thermoregulation |
| ISBN-10 | 3-8359-6978-1 / 3835969781 |
| ISBN-13 | 978-3-8359-6978-0 / 9783835969780 |
| Zustand | Neuware |
| Haben Sie eine Frage zum Produkt? |
Mehr entdecken
aus dem Bereich
aus dem Bereich
Eine sehr persönliche Geschichte | Der New York Times-Bestseller
Buch | Softcover (2023)
Ullstein Taschenbuch Verlag
21,99 €
Die revolutionäre Medizin von morgen (Lifespan)
Buch | Softcover (2020)
DuMont Buchverlag
16,00 €